共價物質指的是只含有共價鍵的物質,其中不含有金屬鍵和離子鍵。共價物質內可能包含一種或多種非金屬元素的原子,所以共價物質就可以分為元素和共價化合物兩大類。
如果分子僅由同一種非金屬元素的原子構成,形成的物質屬於元素。例如,石墨(\(\ce{C}\))、氫分子(\(\ce{H—H}\))、氯分子(\(\ce{Cl—Cl}\))、氧分子(\(\ce{O=O}\))和氮分子(\(\ce{N≡N}\))等。
如果分子由多種非金屬元素的原子構成,形成的物質則是共價化合物。例如水分子(\(\ce{H2O}\))、二氧化碳分子(\(\ce{CO2}\))等。
由分子構成的元素的化學式的寫法是,在元素符號之後以下標的形式標明構成分子的原子數目,如果下標為 \(1\),則要省略不寫。例如:
| 元素 | 化學式寫法 | 舉例 |
|---|---|---|
| 由單原子分子構成 | 原子的元素符號 | 氬(\(\ce{Ar}\)) |
| 由多原子分子構成 | 在原子的元素符號後,以下標的形式標明構成分子的原子數目 | 氧(\(\ce{O2}\))、硫(\(\ce{S8}\)) |
共價物質的結構式,則是直接用共價鍵的符號來表示原子之間共用電子的情況。書寫結構式的步驟如下:
寫出共價物質的化學式
判斷每種原子形成共價鍵的類型(單鍵、雙鍵還是三鍵)和數量
將形成最多共價鍵的原子作為中心原子,用共價鍵的符號表示出不同原子之間共用電子的情況
| 共價物質(化學式) | 總構式 |
|---|---|
| 氫(\(\ce{H2}\)) | \(\ce{H−H}\) |
| 氯(\(\ce{Cl2}\)) | \(\ce{Cl−Cl}\) |
| 氧(\(\ce{O2}\)) | \(\ce{O=O}\) |
| 氮(\(\ce{N2}\)) | \(\ce{N≡N}\) |
| 氯化氫(\(\ce{HCl}\)) | \(\ce{H−Cl}\) |
| 四氯化碳(\(\ce{CCl4}\)) | 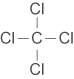 |
| 二氧化碳 | \(\ce{O=C=O}\) |
結構式,只顯示原子之間的共價鍵的形式和數目,不顯示原子的最外層電子的詳細情況。所以,在結構式中,未參與共用的孤電子對不會顯示。
只含有一種非金屬原子的元素的名稱就直接使用該非金屬元素的名稱,例如氫(\(\ce{H2}\))、氧(\(\ce{O2}\))、氮(\(\ce{N2}\))和氬(\(\ce{Ar}\))。
共價化合物的命名則比較複雜。
一些常見的共價化合物,直接用它的俗名而不用化學名稱。例如,水和氨。
由兩種原子組成的共價化合物的命名必須建立在正確書寫化學式的基礎之上。首先,寫出該化合物的化學式。然後,從後至前寫出元素名稱,中間用「化」字連結。最後,將化學式中各原子的數目寫在該原子的元素名稱的前面。注意,氫的數目通常省略不寫。
| 共價化合物的化學式 | 名稱 |
|---|---|
| \(\ce{CO2}\) | 二氧化碳 |
| \(\ce{SO3}\) | 三氧化硫 |
| \(\ce{H2S}\) | 硫化氫 |
| \(\ce{P2O3}\) | 三氧化二磷 |
原子的相對質量稱為相對原子質量,分子的相對質量就稱為相對分子質量。
共價物質的相對分子質量 = 該物質的化學式中的所有原子的相對原子質量的總和。
例如:
水的相對分子質量 |
\(= 2 × \) 氫原子的相對原子質量 \(+\) 氧原子的相對原子質量 |
|
\(= 2 × 1.0 + 16.0\) |
|
\(= 18.0\) |
氮分子的相對分子質量 |
\(= 2 ×\) 氮原子的相對原子質量 |
|
\(= 2 × 14.0\) |
|
\(= 28.0\) |