分子是一個或一組能獨立並穩定存在的原子。
分子是電中性的粒子,分子多是由非金屬元素的原子所組成,並且多數符合八隅體規則。
最簡單的分子就是單原子分子,所有貴氣體都是單原子分子,因為它們都符合八隅體規則,能獨立並穩定存在。例如:氖。
其他非金屬元素的原子要透過與同類生成共價鍵才可獲得八隅體結構。例如:氯原子與氯原子組成雙原子分子。
不同元素的原子也可透過共價鍵獲得八隅體結構,生成化合物。例如兩個氫原子與氧原子生成水分子。水分子同時也是三原子分子。
以下列舉幾個簡單分子的電子圖,從這些例子中我們可看到單鍵、雙鍵和三鍵的表達方式,也可看到雙原子分子和多原子分子的表達方式。
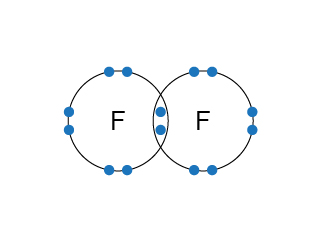
氟分子是雙原子分子,由於氟原子的電子排佈是(\(2,7\)),它只需要 \(1\) 粒最外層電子來完成八隅體的電子排佈,因此氟原子與氟原子只需要各自提供 \(1\) 粒最外層電子,便可組成穩定的結構——氟分子。
在電子圖中,氟原子與氟原子有部分位置是重疊的,而在重疊的部分有 \(1\) 對共價電子。
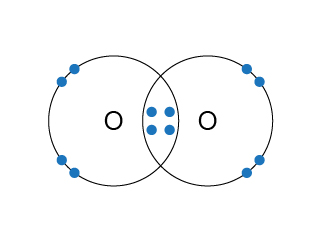
氧分子是雙原子分子,由於氧原子的電子排佈是(\(2,6\)),它需要 \(2\) 粒最外層電子來完成八隅體的電子排佈,因此氧原子與氧原子需要各自提供 \(2\) 粒最外層電子,才可組成穩定的結構——氧分子。
在電子圖中,氧原子與氧原子有部分位置是重疊的,而在重疊的部分有 \(2\) 對共價電子。
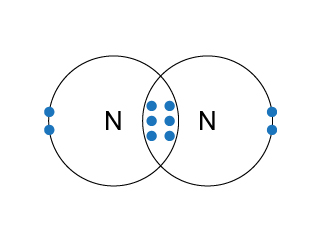
氮分子是雙原子分子,由於氮原子的電子排佈是(\(2,5\)),它需要 \(3\) 粒最外層電子來完成八隅體的電子排佈,因此氮原子與氮原子需要各自提供 \(3\) 粒最外層電子,才可組成穩定的結構——氮分子。
在電子圖中,氮原子與氮原子有部分位置是重疊的,而在重疊的部分有 \(3\) 對共價電子。
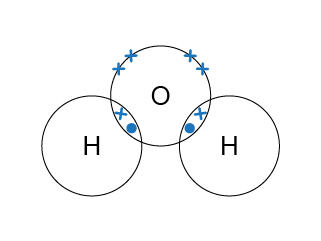
水分子是三原子分子,氧原子的電子排佈是(\(2,6\)),它需要 \(2\) 粒最外層電子來完成八隅體的電子排佈;氫原子的電子排佈是(\(1\)),它只需要 \(1\) 粒電子來完成八隅體的電子排佈。為了滿足各方的需要,\(1\) 個氧原子便會和 \(2\) 個氫原子組成單鍵,而氧原子便是水分子的中心原子。
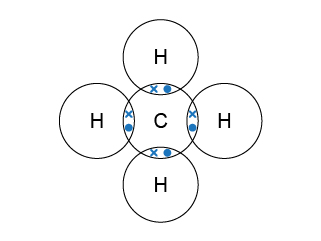
甲烷分子是多原子分子,碳原子的電子排佈是(\(2,4\)),它需要 \(4\) 粒最外層電子來完成八隅體的電子排佈;氫原子的電子排佈是(\(1\)),它只需要 \(1\) 粒電子來完成八隅體的電子排佈。為了滿足各方的需要,\(1\) 個碳原子便會和 \(4\) 個氫原子組成單鍵,而碳原子便是甲烷分子的中心原子。
具有簡單分子結構的物質通常都有某些普遍特性,例如:熔點和沸點一般都很低。
例如:氧分子和水分子。


巨大分子是由數以千計的原子組成的大型分子。
日常生活中,有很多物質都是由巨大分子構成的,組成這些物質的每一個分子,都是有共價鍵結合數以千計的原子組成。
脫氧核糖核酸 (即 \(\ce{DNA}\)) 就是一個巨大分子。
