共價鍵是存在於兩個非金屬原子的原子核與共用電子對之間的強大的靜電吸引力。共價鍵是有方向性的。
共價鍵的方向性是因為共用的電子僅僅受到兩個原子的原子核的吸引,所以這種吸引力只存在於兩個共用電子的原子之間。被兩個原子共用的一對或多對最外層電子,稱為鍵合電子對。最外層沒有參與共用的電子對,稱為孤電子對。
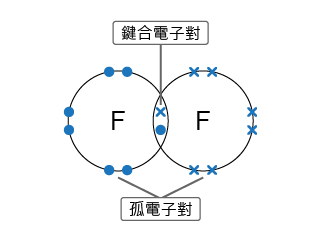
單鍵就是兩個原子之間只共享一對電子所形成的共價鍵。
最簡單的例子就是那些只欠一個電子就達到八隅體的原子。例如:氫 (\(1\))、氟 (\(2,7\)) 和氯 (\(2,8,7\))。因此氫和氫、氟和氟、氯和氯會各自提供一個電子,形成一個鍵合電子對,放在兩個原子中間生成單鍵。
但要是有些原子欠缺兩個或更多電子才獲得八隅體結構,這些原子可與多個原子組成單鍵。例如:氫 (\(1\)) 和氮 (\(2,5\))。因此氫提供一個電子,氮提供三個電子。
雙鍵就是兩個原子之間只共享兩對電子所形成的共價鍵。
最簡單的例子就是那些只欠兩個電子就達到八隅體的原子。例如:氧 (\(2,6\))。因此氧和氧各自提供兩個電子,形成兩對鍵合電子對,放在兩個原子中間生成雙鍵。
但要是有些原子欠缺三個或更多電子才獲得八隅體結構,這些原子可與多個原子組成雙鍵。例如:碳 (\(2,4\)) 和氧 (\(2,6\))。因此碳原子向兩個氧原子各自提供兩個電子,每個氧原子又提供兩個電子,各自形成一個雙鍵。
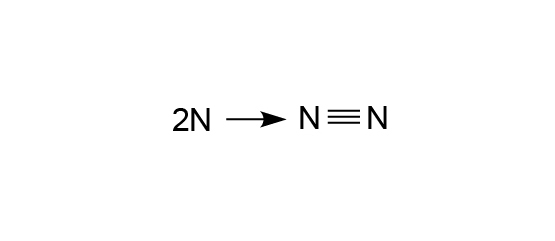
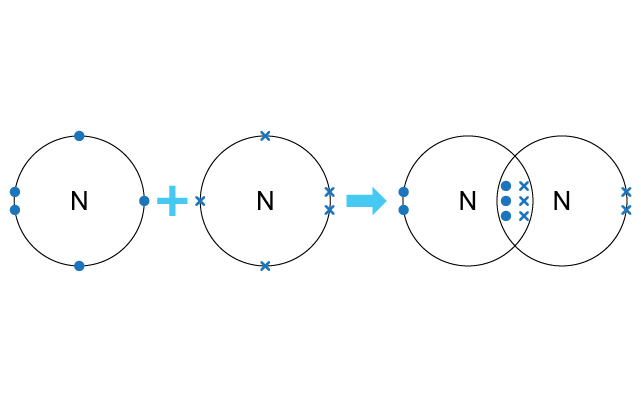
三鍵就是兩個原子之間只共享三對電子所形成的共價鍵。
最簡單的例子就是那些只欠三個電子就達到八隅體的原子。例如:氮 (\(2,5\))。因此氮和氮各自提供三個電子,形成三對鍵合電子對,放在兩個原子中間生成三鍵。
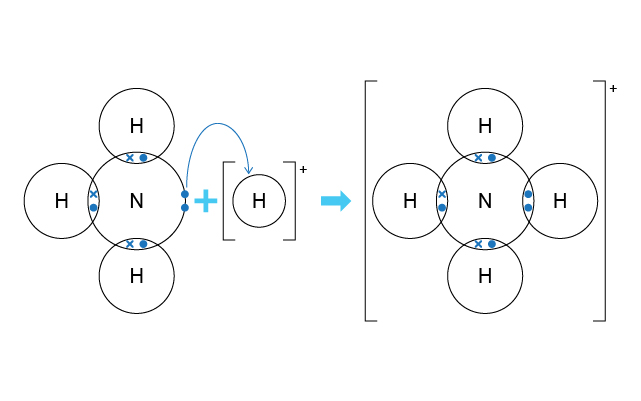
配位鍵是特別的共價鍵,因為涉及其中的鍵合電子對是由其中一個原子提供,另一個原子則是接受這對電子對。雖然這對電子對不是由兩個原子各自提供,但這對電子對還是共享於兩個原子之間。
但要留意,配位鍵只在乎電子的來源,配位鍵可能是單鍵、雙鍵或三鍵,並不存在衝突。
非金屬原子較難失去電子,因此不易形成陽離子。當兩個非金屬原子要獲得八隅體的電子排佈,較傾向透過「電子共享」使兩個非金屬原子獲得穩定的電子排佈。
就以氫原子為例,每個氫原子的電子排佈是 (\(1\))。因此當兩個氫原子要獲得穩定的電子排佈時,它們會互相分享各自擁有的唯一的最外層電子,因此在電子共享之後,每個氫原子都有兩粒最外層電子。
雙鍵就是兩個非金屬原子共享兩對電子。就以氧原子為例,每個氧原子的電子排佈是 (\(2,6\))。因此當兩個氧原子要獲得穩定的電子排佈時,它們會互相分享各自擁有的兩個最外層電子,使兩對電子放在兩個氧原子的原子核中間。
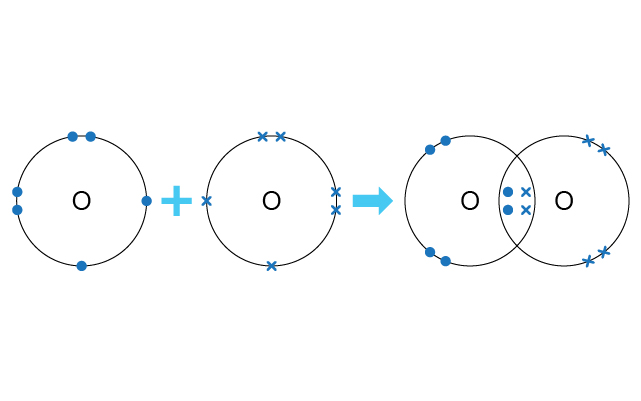
三鍵就是兩個非金屬原子共享三對電子。就以氮原子為例,每個氮原子的電子排佈是 (\(2,5\))。因此當兩個氮原子要獲得穩定的電子排佈時,它們會互相分享各自擁有的三個最外層電子,使三對電子放在兩個氧原子的原子核中間。
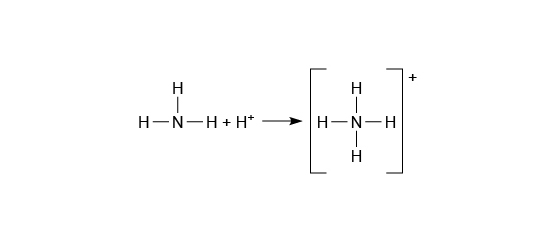
配位鍵是特別的共價鍵,因為涉及其中的鍵合電子對是由其中一個原子提供,另一個原子則是接受這對電子對。雖然這對電子對不是由兩個原子各自提供,但這對電子對還是共享於兩個原子之間。
例如:氨分子有一對孤電子對,而氫離子則欠缺一對電子才填滿最外層的電子層。氨分子向氫離子提供自己的孤電子對,從而生成銨離子 (\(\ce{NH4^{+}}\))。
我們先畫出氨分子和氫離子的電子圖,然後用彎曲的箭頭,從氨分子的孤電子對指向氫離子的空的電子層表。這表示孤電子對的去向。