硅酸鹽是指由硅和氧組成的化合物。顧名思義,它可由硅酸 (\(\rm{H}_{4}\rm{SiO}_{4}\)) 透過化學反應而生成,硅酸鹽的基本建構單位是 \( \ce{[SiO4 ]^4- } \)。
\( \ce{H4SiO4 (aq) + 4NaOH (aq) -> SiO4^4- (aq) + 4Na+ (aq) + 4H2O (l) } \)

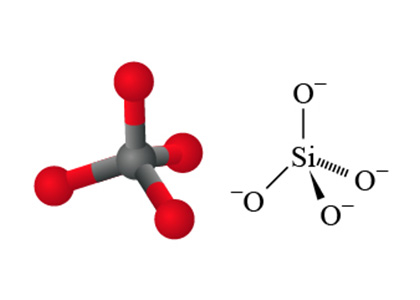
\(\text{Si}{{\text{O}}_{\text{4}}}^{\text{4}-}\)離子是硅酸鹽的基本建構單位,每 \(1\) 個硅原子都被 \(4\) 個氧原子包圍著,形成一個四面體的硅酸根離子。由於每個氧原子都帶一個負電荷,因此每個四面體硅酸根離子都帶有 \(4\) 個負電荷。
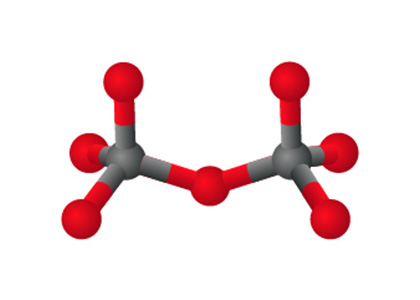
在硅酸鹽中,每一個硅酸根離子會與相鄰的硅酸根離子共用氧原子,形成 \(\text{S}{{\text{i}}_{\text{2}}}{{\text{O}}_{\text{7}}}^{\text{6}-}\)。
鏈狀的硅酸鹽透過共用處於角位的氧原子,把四面體的硅酸根離子串連成單鏈。但要注意,這些鏈狀的硅酸鹽都是帶負電荷,因此硅酸鹽的結構中必須擁有其他帶正電荷的離子(例如金屬離子)來保持電中性。
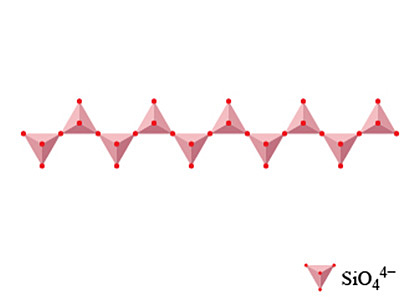
在鏈狀的硅酸鹽中,每一個硅原子擁有 \(2\) 個獨自擁有的氧原子及 \(2\) 個共享的氧原子。
\[每個硅原子所擁有的氧原子數目=2+\frac{1}{2}+\frac{1}{2}\]
\[每個硅原子所擁有的氧原子數目=3\]
在 \(\text{Si}{{\text{O}}_{\text{3}}}^{\text{2}-}\) 中,每個硅原子獨自擁有的氧原子都帶 \(1\) 個負電荷,而共享的氧原子則不帶負電荷,因此 \(\text{Si}{{\text{O}}_{\text{3}}}^{\text{2}-}\) 都帶 \(2\) 個負電荷。
閃石是石棉的一種,擁有鏈狀結構。
閃石的化學式是 \(\ce{Ca2Mg5 (Si4O11)2(OH)2 }\)

層狀硅酸鹽可以由 \(2\) 條鏈狀硅酸鹽連結而成。在層狀硅酸鹽中,每個 \(\text{Si}{{\text{O}}_{\text{4}}}^{\text{4}-}\) 四面體與相鄰的 \(\text{Si}{{\text{O}}_{\text{4}}}^{\text{4}-}\) 四面體共用 \(2\) 個或 \(3\) 個氧原子。
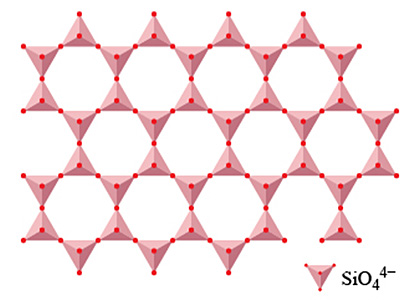
在層狀硅酸鹽,
\[每個硅原子所擁有的氧原子數目=1+\frac{1}{2}+\frac{1}{2}+\frac{1}{2}\]
\[每個硅原子所擁有的氧原子數目=\frac{5}{2}\]
因此,硅原子對氧原子的比例是 \(2:5\)。但我們要留意,每個硅原子獨自擁有的氧原子都擁有 \(1\) 個負電荷,而共享的氧原子則不帶電荷。
所以,我們可以用 \({{(\text{S}{{\text{i}}_{\text{2}}}{{\text{O}}_{\text{5}}}^{\text{2}-})}_{\text{n}}}\) 來表示整體結構,而它的重複單位就是 \(\text{S}{{\text{i}}_{\text{2}}}{{\text{O}}_{\text{5}}}^{\text{2}-}\)。
滑石就是擁有層狀結構的硅酸鹽,它的化學式是 \(\text{M}{{\text{g}}_{\text{3}}}\text{(S}{{\text{i}}_{\text{4}}}{{\text{O}}_{\text{10}}}\text{)(OH}{{\text{)}}_{\text{2}}}\)。

網狀硅酸鹽可以由層狀硅酸鹽連結而成。在網狀硅酸鹽中,每個 \(\text{Si}{{\text{O}}_{\text{4}}}^{\text{4}-}\) 四面體中的 \(4\) 個氧原子都是與相鄰的 \(\text{Si}{{\text{O}}_{\text{4}}}^{\text{4}-}\) 的四面體共用,構成三維網絡。
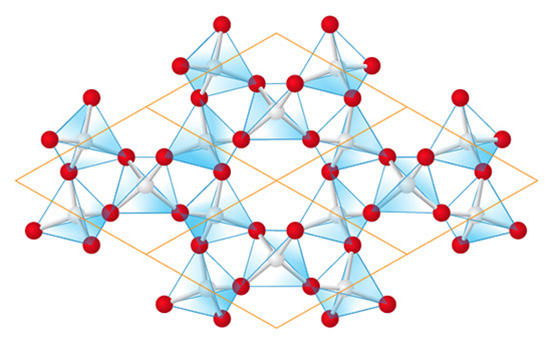
在網狀硅酸鹽,
\[每個硅原子所擁有的氧原子數目=\frac{1}{2}+\frac{1}{2}+\frac{1}{2}+\frac{1}{2}\]
\[每個硅原子所擁有的氧原子數目=2\]
因此,硅原子對氧原子的比例是 \(1:2\)。但我們要留意,每個硅原子都擁有 \(4\) 個共享的氧原子則不帶電荷。
所以,我們可以用 \({{(Si{{O}_{2}})}_{n}}\) 來表示整體結構,而它的重複單位就是 \(Si{{O}_{2}}\)。
石英就是擁有網狀結構的硅酸鹽,它的化學式是 \(Si{{O}_{2}}\)。
