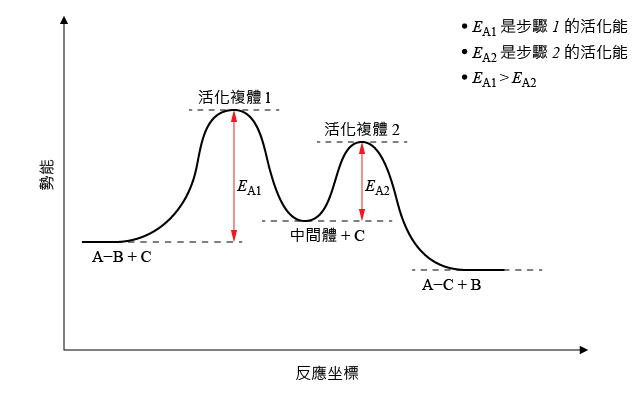
大部分化學反應,在反應物向生成物的轉化過程中,並不止涉及一個步驟,往往會經過一個或多個中間體。例如,對於下面的化學反應:
\[\text{A}-\text{B}\ +\ \text{C}\ \to \ \text{A}-\text{C}\ +\ \text{B}\]實際上,在反應過程中會分成兩個步驟進行:
右側的能線圖中,展示了該反應過程中,兩個步驟的活化能差異。比較活化能,思考活化能的高低與反應速率的關係。
從能線圖可以看出:步驟 \(1\) 涉及的活化能較高,反應速率較慢;而步驟 \(2\) 涉及的活化能較低,反應速率較快。
這是因為,活化能越高,具有足夠的動能去越過能障的分子數就越少,該步驟的反應速率就越低。
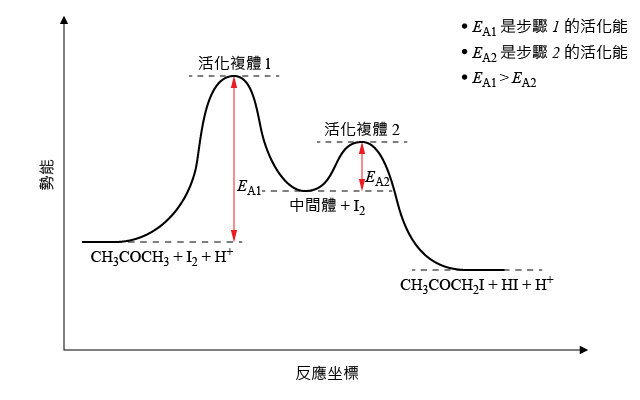
化學家們將從反應物轉化成生成物的一系列步驟,稱為反應機理。其中,反應最慢的步驟,稱為速率控制步驟。可以通過實驗,測出反應的速率方程式,然後推測反應機理。例如,參照下面的反應:
\[\text{C}{{\text{H}}_{\text{3}}}\text{COC}{{\text{H}}_{\text{3}}}\left( \text{aq} \right)\ +\ {{\text{I}}_{\text{2}}}\left( \text{aq} \right) \xrightarrow{ {{\text{H}}^{+}}\left( \text{aq} \right) }\ \text{C}{{\text{H}}_{\text{3}}}\text{COC}{{\text{H}}_{\text{2}}}\text{I}\left( \text{aq} \right)\ +\ \text{HI}\left( \text{aq} \right)\]已知該反應的速率方程式可寫作:
\[\text{反應速率}\ =\ k\left[ \text{C}{{\text{H}}_{\text{3}}}\text{COC}{{\text{H}}_{\text{3}}}\left( \text{aq} \right) \right]\left[ {{\text{H}}^{+}}\left( \text{aq} \right) \right]\]思考以下哪個反應機理更加合理,並繪製該反應的能線圖。
由速率方程可知,反應速率由 \(\left[ \text{C}{{\text{H}}_{\text{3}}}\text{COC}{{\text{H}}_{\text{3}}}\left( \text{aq} \right) \right]\) 和 \(\left[ {{\text{H}}^{+}}\left( \text{aq} \right) \right]\) 決定,所以這兩種物質一定在反應速率低的步驟(即速率控制步驟)中出現。
對比兩個反應機理,可以發現:機理二中,\(\text{C}{{\text{H}}_{\text{3}}}\text{COC}{{\text{H}}_{\text{3}}}\left( \text{aq} \right)\) 和 \({{\text{H}}^{+}}\left( \text{aq} \right)\) 會緩慢生成中間體;中間體再與 \({{\text{I}}_{\text{2}}}\) 快速反應,生成生成物。\({{\text{I}}_{\text{2}}}\) 不在速率方程式中出現,所以,機理二更加合理。
該反應的能線圖可由下圖描述: