在非離子化合物中,各原子並不是真正的帶有電荷。化學家們為了方便表示化合物中各原子得失電子的能力,根據一系列的規則,為這些化合物訂定「想象性電荷」——氧化數。
根據以下步驟,結合氧化數的訂定規則,完成測試中元素氧化數的相關題目。
氧化數的訂定規則
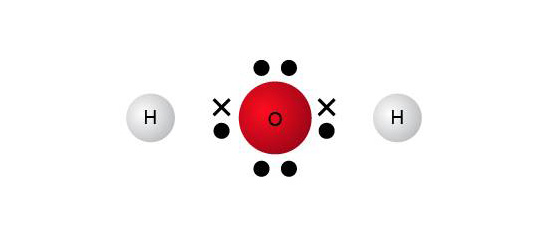
由於氧化數只是一種想像性電荷,因此,容易使人對物質結構產生誤解。
例如,在 \({{\text{H}}_{\text{2}}}\text{O}\) 中,氫的氧化數是 \(\text{+1}\),氧的氧化數是 \(-2\),這可能會使人誤以為氫原子帶一個正電荷,而氧原子帶兩個負電荷。事實上,氫原子與氧原子之間是共用電子,只是電子比較偏向氧原子而已。