金屬在電化序中的相對位置能夠反映金屬在化學電池內失去電子形成離子的相對趨勢。因此,根據金屬在電化序中的相對位置就可以預測簡單化學電池內電極的正負、電子的流動方向以及電池內發生的化學反應。
如下圖所示,把鎂片和銅片插入檸檬中,再將兩金屬片用導線連接就可以製成簡單的檸檬電池。根據所學內容回答右側的問題。
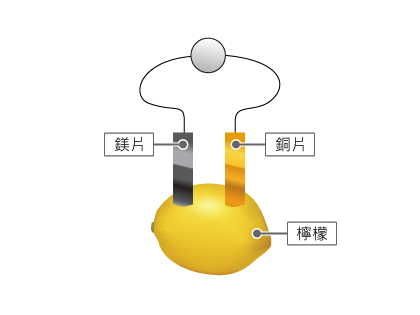
1、在實驗室中,以下哪項/哪些儀器常用來量度簡單化學電池的電壓?
伏特計
安培計
數字萬用表
題解:
數字萬用表常用來代替伏特計測量電壓;而安培計是量度電流的儀器。
2、以下哪項/哪些關於電子流動的描述是正確的?
由鎂片經導線流向銅片
由鎂片經檸檬流向銅片
由銅片經導線流向鎂片
由銅片經檸檬流向鎂片
題解:
在電化序中,鎂位於銅之上,更易失去電子形成離子。所以,電子從鎂電極流出。電子只在外電路流動,不能在電解質溶液中流動。
3、以下哪項/哪些離子反應式能夠展示化學電池內的化學變化?
\(\text{Mg}\left( \text{s} \right)\ \to \ \text{M}{{\text{g}}^{\text{2+}}}\left( \text{aq} \right)\ \text{+}\ \text{2}{{\text{e}}^{-}}\)
\(\text{Cu}\left( \text{s} \right)\ \to \ \text{C}{{\text{u}}^{\text{2+}}}\left( \text{aq} \right)\ \text{+}\ \text{2}{{\text{e}}^{-}}\)
題解:
在電化序中,鎂位於銅之上,更易失去電子形成離子。所以,涉及的化學反應是鎂原子失去電子形成鎂離子。
4、如果以鋅片代替鎂片,電池的電壓將會發生怎樣的變化?
升高
降低
不變
為零
題解:
在電化序中,鋅位於鎂的下方,與銅的距離更近。所以,電壓降低。
5、如果以蔗糖溶液代替檸檬,電池的電壓將會發生怎樣的變化?
升高
降低
不變
為零
題解:
蔗糖不是電解質。所以,蔗糖溶液不能導電,電壓為零。
下圖所示的是鋅片和某金屬組成的化學電池。根據圖示內容回答右側的問題。
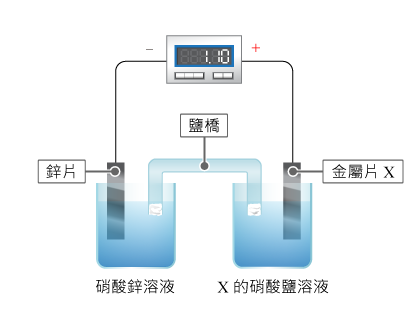
1、電子在外電路如何流動?
由鋅流向金屬 \(\rm{X}\)
由金屬 \(\rm{X}\) 流向鋅
題解:
如圖所示,鋅與萬用表的負端鈕連接時產生的電壓為正。所以,鋅是電池的負極。
2、以下哪些金屬有可能是金屬 \(\rm{X}\)?
鋁
鎂
銅
鉛
題解:
鋅電極作為電池的負極時,金屬 \(\rm{X}\) 在電化序中必須位於鋅之下。
3、以下哪項離子反應式展示了鋅電極涉及的化學變化?
\(\text{Zn}\left( \text{s} \right)\ \to \ \text{Z}{{\text{n}}^{\text{2+}}}\left( \text{aq} \right)\ \text{+}\ \text{2}{{\text{e}}^{-}}\)
\(\text{Z}{{\text{n}}^{\text{2+}}}\left( \text{aq} \right)\ \text{+}\ \text{2}{{\text{e}}^{-}}\ \to \ \text{Zn}\left( \text{s} \right)\)
題解:
鋅是電池的負極,失去電子形成鋅離子。
4、以下哪項/哪些關於鹽橋的描述是正確的?
提供自由游動的離子避免半電池內電荷的累積
連接兩個半電池形成閉合回路
允許兩個半電池中的離子在鹽橋中自由游動
允許電子在兩個半電池之間自由游動
題解:
鹽橋提供自由游動的離子,形成閉合回路,並中和半電池內積累的電荷。
5、若以鎂代替金屬 \(\rm{X}\),則萬用表的示數會發生怎樣的變化?
數值升高
數值降低
無法判斷數值變化
符號不變
符號為負
無法判斷符號變化
題解:
電化序中,鎂位於鋅的上方。所以,組成化學電池時,鎂是負極。若鎂連接萬用表的正端鈕時,示數為負。由於不能確定金屬 \(\rm{X}\) 的種類,所以無法判斷兩個化學電池電壓的相對大小。
注意:比較電池的電壓大小時,必須有一種金屬電極是相同的,且為同一性質的電極(正極或負極)。