滴定法可以用來測定溶液中待分析物質的濃度或分量,從而進行相關的計算。但是,如果待分析物質在水中的溶解性較差,例如氧化鎂、氫氧化鎂等,就無法直接用滴定法來測定樣本中的相應物質的含量,此時就需要利用返滴定法來解決問題。
返滴定法是利用不溶於水的鹽基或碳酸鹽與酸反應生成可溶鹽,繼而滴定剩餘酸的量來計算參與反應的樣本的量。其具體步驟如下:
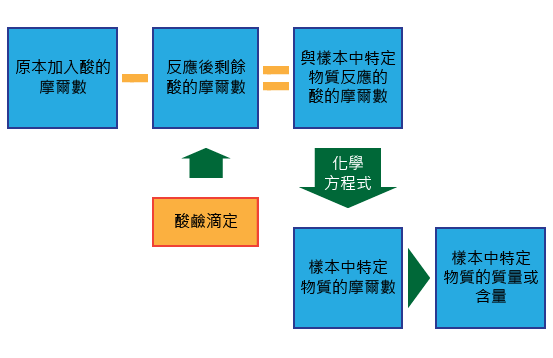
一名同學為了利用返滴定法測定含雜質樣本中氫氧化鎂的含量,進行了以下實驗:
根據以上信息回答下列問題(答案保留至三位有效數字;氫氧化鎂的摩爾質量為 \(\text{58}\text{.3}\ \text{g}\ \text{mo}{{\text{l}}^{-1}}\)):
題解:
參照下面的化學反應式可知:參與反應的氫氧化鈉的摩爾數等於氯化氫的摩爾數。
\[\text{NaOH}\left( \text{aq} \right)\ +\ \text{HCl}\left( \text{aq} \right)\ \to \ \text{NaCl}\left( \text{aq} \right)\ +\ {{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\]所以,可以計算稀釋後氫氯酸的摩爾濃度為:
\[0.03\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\times \frac{24.5\ \text{c}{{\text{m}}^{3}}}{25.0\ \text{c}{{\text{m}}^{3}}}=0.0294\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\]剩餘氫氯酸的摩爾數可通過稀釋後溶液中氫氯酸的摩爾濃度和溶液的總體積來獲得。所以,剩餘氫氯酸的摩爾數為:
\[0.0294\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\times 250.0\ \text{c}{{\text{m}}^{3}}=0.00735\ \text{mol}\]由已知條件可得,氫氯酸的總摩爾數為:
\[1.25\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\times 25.0\ \text{c}{{\text{m}}^{3}}=0.03125\ \text{mol}\]所以,與樣本反應的氫氯酸的摩爾數為:
\[0.03125\ \text{mol}-0.00735\ \text{mol}=0.0239\ \text{mol}\]參照下面的化學反應式可知:參與反應的氫氧化鎂的摩爾數是氯化氫摩爾數的一半。
\[\text{Mg}{{\left( \text{OH} \right)}_{2}}\left( \text{s} \right)\ +\ 2\text{HCl}\left( \text{aq} \right)\ \to \ \text{MgC}{{\text{l}}_{\text{2}}}\left( \text{aq} \right)\ +\ 2{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\]所以,樣本中氫氧化鎂的摩爾數為:
\[\frac{1}{2}\times 0.0239\ \text{mol}=0.01195\ \text{mol}\]所以,樣本中氫氧化鎂的質量百分比為:
\[\frac{0.01195\ \text{mol}\times 58.3\ \text{g}\ \text{mo}{{\text{l}}^{-1}}}{0.80\ \text{g}}\times 100\%=87.1\%\]