赫斯定律指出一個化學反應的焓變,取決於起始狀態和最終狀態,而與反應的具體路徑無關。我們可以根據不同的反應途徑來繪製成封閉圖形,就得到描述化學反應各個途徑的焓變之間關係的焓變循環。
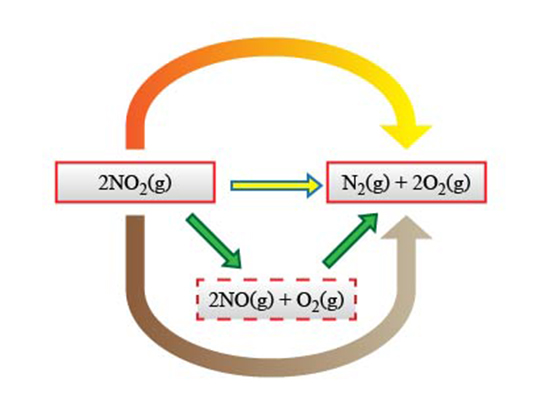
若已知二氧化氮、一氧化氮、氮與氧之間存在著以下反應關係。
\(\text{2N}{{\text{O}}_{2}}(\text{g})\to \text{2NO}(\text{g})\ \text{+}\ {{\text{O}}_{\text{2}}}(\text{g})\)
\(\text{2NO}(\text{g})\to {{\text{N}}_{2}}(\text{g})\ \text{+}\ {{\text{O}}_{\text{2}}}(\text{g})\)
\(\text{2N}{{\text{O}}_{2}}(\text{g})\to {{\text{N}}_{2}}(\text{g})\ \text{+}\ \text{2}{{\text{O}}_{\text{2}}}(\text{g})\)
根據赫斯定律完成右側的互動。
結合相關的反應關係和焓變,我們可以利用焓變循環計算一個化學反應的焓變。請同學們結合以下資料,根據右圖所示的焓變循環計算 \(\text{ }\!\!\Delta\!\!\text{ }{{H}_{\text{3}}}\) 的值。
\({\rm{2N}}{{\rm{O}}_2}{\rm{(g)}} \to {\rm{2NO(g) + }}{{\rm{O}}_{\rm{2}}}{\rm{(g)}}\quad \Delta {H_1} = + 114.4\;{\rm{kJ}}\;{\rm{mo}}{{\rm{l}}^{{\rm{ - 1}}}}\)
\({\rm{2NO(g)}} \to {{\rm{N}}_2}{\rm{(g) + }}{{\rm{O}}_{\rm{2}}}{\rm{(g)}}\quad \Delta {H_2} = - 180.8\;{\rm{kJ}}\;{\rm{mo}}{{\rm{l}}^{{\rm{ - 1}}}}\)
\({\rm{2N}}{{\rm{O}}_2}{\rm{(g)}} \to {{\rm{N}}_2}{\rm{(g) + 2}}{{\rm{O}}_{\rm{2}}}{\rm{(g)}}\quad \Delta {H_3} = ?\;{\rm{kJ}}\;{\rm{mo}}{{\rm{l}}^{{\rm{ - 1}}}}\)
A. \(+295.2\ \text{kJ}\ \text{mo}{{\text{l}}^{-\text{1}}}\)
B. \(-295.2\ \text{kJ}\ \text{mo}{{\text{l}}^{-\text{1}}}\)
C. \(+66.4\ \text{kJ}\ \text{mo}{{\text{l}}^{-\text{1}}}\)
D. \(-66.4\ \text{kJ}\ \text{mo}{{\text{l}}^{-\text{1}}}\)
結論:
根據赫斯定律:如果能夠把一個反應寫成幾個步驟,那麼整體反應的焓變必然等於幾個步驟的焓變的總和。