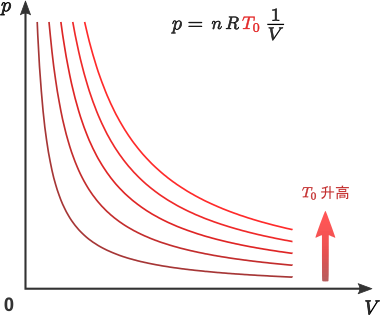
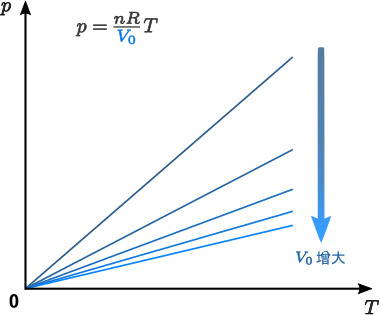
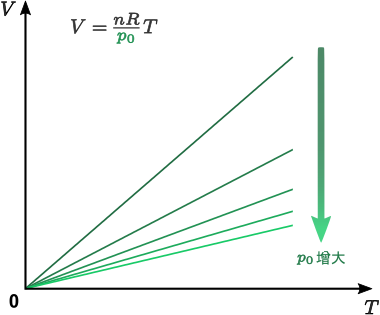
結合前述的波義耳定律、氣壓定律與查理定律可得知,對於一定量的氣體,其氣壓 \(p\)、體積 \(V\) 和溫度 \(T\) 滿足關係 \[\frac{p\,V}{T}=\textrm{常數}\] 稱為普適氣體定律。而上述三定律,則分別對應普適氣體定律在固定溫度、固定體積和固定壓強下的形式。
不難想像,當氣體的壓強與溫度不變時,氣體的體積應該與其分子數目成正比。由此,普適氣體定律可進一步表述為 \[\frac{p\,V}{T}=n\,R\] \(n\) 為氣體分子的摩爾數(即 \(n=N/N_\textrm{A}\),\(N\) 為氣體分子的數目,\(N_\textrm{A}=6.02\times 10^{23}\) 為一摩爾氣體所含分子的數目),比例常數 \(R\) 稱為普適氣體常數,其實驗值為 \(8.31~\textrm{J}\,\textrm{mol}^{-1}\,\textrm{K}^{-1}\)。