一般而言,在金屬活性序中位置愈高的金屬,其活性愈高,愈傾向於以化合物的形式存在。利用這一原則,我們可以預測某些金屬的反應,如從金屬氧化物中提取金屬的反應。
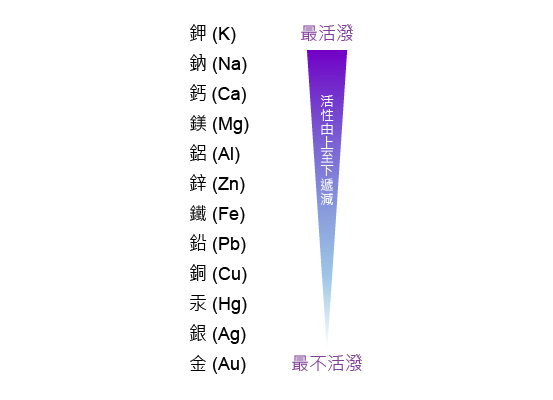
從金屬氧化物中提取金屬,主要有三種方法。
直接加熱某些金屬的氧化物,可得到相應的金屬。例如,直接加熱氧化汞(\(\text{II}\)),可生成汞。
\[\ce{2HgO(s) -> 2Hg(l) + O2(g)}\]由於汞的活性高於銀,因此,這個方法亦適用於從氧化銀中獲取銀。
\[\ce{2Ag2O(s) -> 4Ag(s) + O2(g)}\]由於直接加熱氧化銅(\(\text{II}\))不能得到銅,因此,可以推測:直接加熱其他活性高於銅的金屬氧化物,亦不能得到相應的金屬。
用碳還原某些金屬的氧化物,可得到相應的金屬。例如,氧化鋅與碳共熱,可生成鋅。
\[\ce{2ZnO(s) + C(s) -> 2Zn(s) + CO2(g)}\]因此,這個方法亦適用於從其他活性低於鋅的金屬氧化物中獲取相應金屬。例如,氧化銅(\(\text{II}\))與碳共熱,可生成銅。
\[\ce{2CuO(s) + C(s) -> 2Cu(s) + CO2(g)}\]若把一種金屬的氧化物與另一種在活性序中位置高於它的金屬混合加熱,可以將其還原。例如,將鋁粉和氧化鐵(\(\text{III}\))粉末共熱,可生成鐵。
\[\ce{Fe2O3(s) + 2Al(s) -> 2Fe(s) + Al2O3(s)}\]這是因為鋁的活性高於鐵,更傾向於以化合物的形式存在,因此,在化學反應中,鋁奪去了氧化鐵(\(\text{III}\))中的氧。若將鐵與氧化鋁共熱,則不會發生反應。