不同金屬的活性不同。究竟是甚麼原因決定了金屬的活性高低呢?
活性,指的是發生化學反應的難易程度。在化學反應中,金屬容易失去電子,形成陽離子,以獲得貴氣體原子的電子排佈。因此,金屬活性的高低,主要取決於金屬原子失去最外層電子的難易程度。
金屬的活性愈高,表示該金屬的原子愈容易失去最外層電子,以形成陽離子。
哪些因素影響或決定了金屬原子失去電子的難易程度呢?
我們以鉀、鈉和鎂為例,解釋一些金屬原子失去電子的難易程度不同的原因。
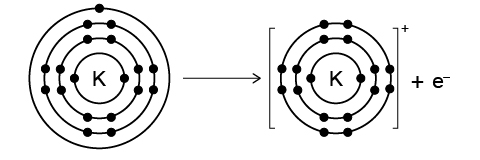
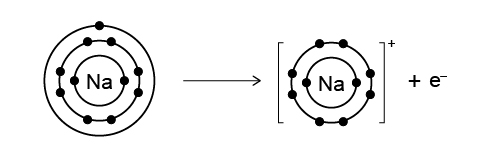
鉀 (\(\text{K}\)) 和鈉 (\(\text{Na}\)) 都是鹼金屬。在化學反應中,鉀原子和鈉原子都很容易失去一個電子,形成陽離子。與鈉原子相比,鉀原子的最外層電子位於第三電子層,距離原子核更遠,更容易失去。因此,鉀的活性高於鈉。
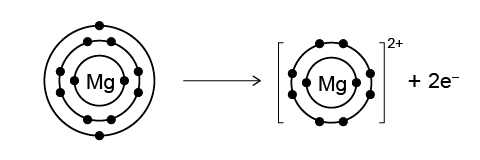
鈉 (\(\text{Na}\)) 和鎂 (\(\text{Mg}\)) 都是第三週期元素。在化學反應中,鈉原子會失去一個電子,而鎂原子會失去兩個電子,以形成穩定的陽離子。失去一個電子比失去兩個電子更容易,因此,鈉的活性高於鎂。
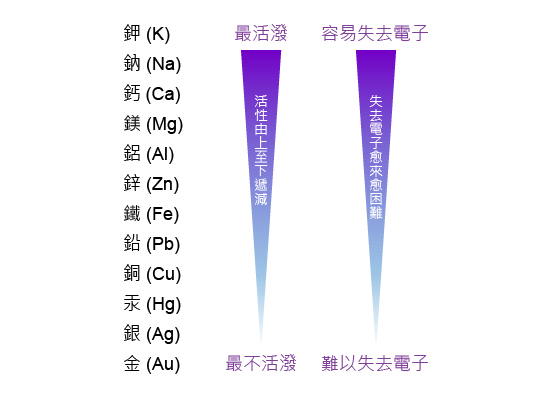
因此,鉀 (\(\text{K}\)) 的活性 > 鈉 (\(\text{Na}\)) 的活性 > 鎂 (\(\text{Mg}\)) 的活性。