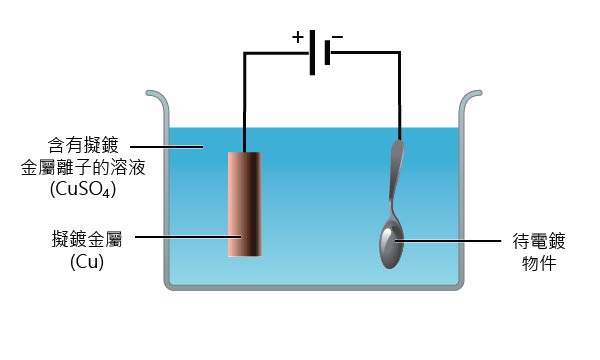
電鍍是指用電解的方法,把一層金屬覆蓋在物件表面的過程。電鍍可防止物品被腐蝕,同時能令物品更美觀。常用於電鍍的金屬有銅、銀、金、錫和鉻。
電鍍在電解池 (通常稱為「電鍍槽」) 中進行,以待電鍍的金屬物體作為陰極,擬鍍金屬 \(\ce{M} \) 作為陽極,並以含有 \(\ce{M$^{n+}$ (aq)} \) 的水溶液作為電解質溶液。在接通直流電後,溶液中的 \(\ce{M$^{n+}$ (aq)} \) 會在作為陰極的待電鍍金屬物件的表面放電,生成一層金屬 \(\ce{M(s)} \);同時,作為陽極的擬鍍金屬 \(\ce{M(s)} \) 本身放電,生成 \(\ce{M$^{n+}$ (aq)} \) 進入到溶液中。在整個過程中,溶液中金屬離子的數目保持不變。
\[ \begin{align*} \ce{ M$^{n+}$ (aq) + ne^{-} &-> M(s) \tag{$陰極反應$} \\} \ce{ M(s) &-> M$^{n+}$ (aq) + ne^{-} \tag{$陽極反應$} } \end{align*} \]例如在電鍍銅的實驗中,以待電鍍的金屬物件作為陰極,金屬 \(\ce{Cu} \) 作為陽極,並以含有 \(\ce{Cu^2+ (aq) } \) 的溶液作為電解質溶液。通電一段時間後,金屬物件表面會被鍍上一層銅。