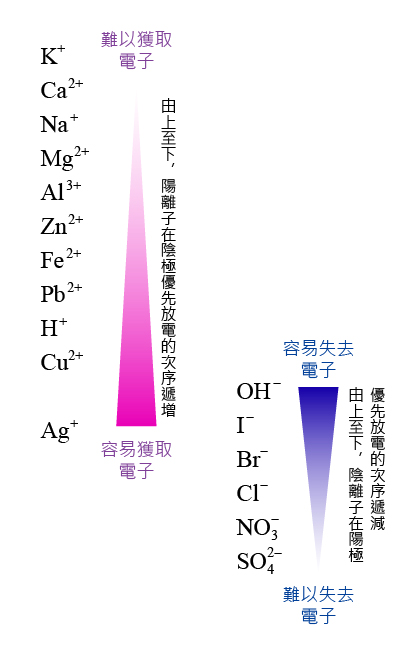
一般而言,離子在電化序中的相對位置決定了它們的優先放電次序。
在電化序中位置愈低的陽離子,愈容易在陰極上放電。
在陰極上,陽離子獲得電子,發生還原反應,是氧化劑。在電化序中位置較低的陽離子較容易獲得電子,是較強的氧化劑,優先放電。
在電化序中位置愈高的陰離子,愈容易在陽極上放電。
在陽極上,陰離子失去電子,發生氧化反應,是還原劑。在電化序中位置較高的陰離子較容易失去電子,是較強的還原劑,優先放電。
特別地,\(\ce{SO4^2- (aq)} \) 和 \(\ce{NO3^- (aq)} \) 是極弱的還原劑,它們不會在水溶液中放電。