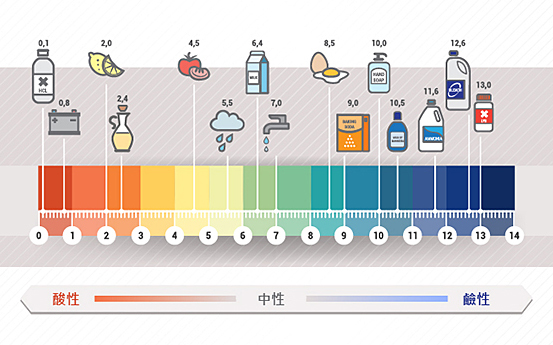
稀酸的性質取決於溶液中氫離子的濃度:氫離子濃度不同時,溶液的酸度也不同。但是,當溶液中氫離子濃度很低時,直接使用氫離子濃度,來表示就會複雜不便。\(1909\) 年,丹麥生物化學家提出了 \(\rm{pH}\) 標度 的概念,用以簡便地記錄和比較溶液的酸度。右表展示了氫離子濃度與溶液 \(\rm{pH}\) 值的關係,可以看出:
| 氫離子濃度 \(\left( \text{mol}\ \text{d}{{\text{m}}^{-3}} \right)\) | \(\rm{pH}\) 值 | 氫離子濃度 \(\left( \text{mol}\ \text{d}{{\text{m}}^{-3}} \right)\) | \(\rm{pH}\) 值 |
|---|---|---|---|
| \({{10}^{0}}\) | \(0\) | \({{10}^{-7}}\) | \(7\) |
| \({{10}^{-1}}\) | \(1\) | \({{10}^{-8}}\) | \(8\) |
| \({{10}^{-2}}\) | \(2\) | \({{10}^{-9}}\) | \(9\) |
| \({{10}^{-3}}\) | \(3\) | \({{10}^{-10}}\) | \(10\) |
| \({{10}^{-4}}\) | \(4\) | \({{10}^{-11}}\) | \(11\) |
| \({{10}^{-5}}\) | \(5\) | \({{10}^{-12}}\) | \(12\) |
| \({{10}^{-6}}\) | \(6\) | \({{10}^{-13}}\) | \(13\) |
| \({{10}^{-7}}\) | \(7\) | \({{10}^{-14}}\) | \(14\) |
根據 \(\rm{pH}\) 值的定義,計算右表中不同溶液的 \(\rm{pH}\) 值或氫離子的摩爾濃度,並將結果填寫在空格處。(答案保留至小數點後兩位。氫離子濃度以科學計數法表示,例如:若答案為 \(0.00210\) 則表示為 2.10*10^-3。)
| 溶液 | \(\rm{pH}\) 值 | 氫離子摩爾濃度 \(\left( \text{mol}\ \text{d}{{\text{m}}^{-3}} \right)\) |
|---|---|---|
| 牛奶 | \(6.40\) | |
| 硫酸 | \(0.05\) | |
| 氫氯酸 | \(0.05\) | |
| 橙汁 | \(3.50\) | |
| 通渠劑 | \(12.0\) |
生活中很多物質都具有不同的酸鹼性,以達至生活中使用的目的。