金屬碳酸鹽不能直接由其成分元素化合而成,因此,其生成焓變亦不能直接通過實驗獲得。
\[\text{Mg}\left( \text{s} \right) \ \text{+} \ \text{C}\left( \text{石墨} \right) \ \text{+} \ \frac{3}{\text{2}}{{\text{O}}_{\text{2}}}\left( \text{g} \right) \longrightarrow \llap{{\color{red}\times}\,\,\,\,} \text{MgC}{{\text{O}}_{\text{3}}}\left( \text{s} \right)\]
然而,我們卻可以利用赫斯定律間接獲得碳酸鹽的生成焓變。在右側的互動中,將以碳酸鎂為例介紹如何設計實驗獲得碳酸鹽的標準生成焓變。
金屬鎂和碳酸鎂都可與稀酸(例如稀氫氯酸)發生化學反應。根據這一性質,繪畫與待求焓變相關的焓變循環,並寫出計算碳酸鎂標準生成焓變的反應式。
\[\text{Mg}\left( \text{s} \right)\ \text{+}\ \text{C}\left( \text{石墨} \right)\ \text{+}\ \frac{3}{\text{2}}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \to \ \text{MgC}{{\text{O}}_{\text{3}}}\left( \text{s} \right)\ \ \ \ \ \Delta {{H}_{\text{f}}}^{\rlap{-} o}\left[ \text{MgC}{{\text{O}}_{\text{3}}}\left( \text{s} \right) \right]=?\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}}\]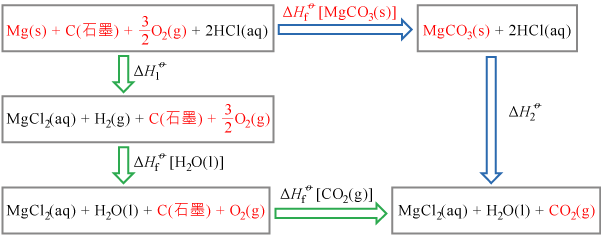
根據赫斯定律:
\(\Delta{{H}_{\text{f}}}^{\rlap{-} o} \left[ \text{MgC}{{\text{O}}_{\text{3}}}\left( \text{s} \right) \right] \ \text{=} \ \Delta{{H}_{\text{1}}}^{\rlap{-} o} \ \text{+} \ \Delta{{H}_{\text{f}}}^{\rlap{-} o} \left[ {{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right) \right] \ \text{+} \ \Delta{{H}_{\text{f}}}^{\rlap{-} o} \left[ \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) \right] - \Delta{{H}_{\text{2}}}^{\rlap{-} o}\)
利用簡單量熱法量度金屬鎂與稀氫氯酸反應的焓變。將 \(\rm{0.225\ g}\) 金屬鎂加入稀氫氯酸中,反應完成後混合物的溫度升高了 \(\rm{7.9\ K}\)。假設稀氫氯酸的熱容量為 \(546\ \text{J}\ \text{mo}{{\text{l}}^{-1}}\),而聚苯乙烯杯子的熱容量可略去不計。金屬鎂的相對原子質量為 \(24.3\);答案保留至整數部分。
題解:
首先,計算反應過程中放出的熱:
\[Q=546\ \text{J}\ {{\text{K}}^{-1}}\times 7.9\ \text{K}=4\ 313\ \text{J }=4.31\ \text{kJ}\]然後,計算參與反應的鎂的摩爾數:
\[n=\frac{0.225\ \text{g}}{24.3\ \text{g}\ \text{mo}{{\text{l}}^{-1}}}=0.00926\ \text{mol}=9.26\times {{10}^{-3}}\ \text{mol}\]最後,計算反應的焓變(注意,放熱反應的焓變為負。):
\[\Delta {{H}_{\text{r}}}=-\frac{4.31\ \text{kJ}}{9.26\times {{10}^{-3}}\ \text{mol}}=-465\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}}\]我們同樣可以利用簡單量熱法量度碳酸鎂與稀氫氯酸反應的焓變。將 \(\rm{3.20\ g}\) 碳酸鎂加入稀氫氯酸中,反應完成後混合物的溫度升高了 \(\rm{6.2\ K}\)。假設稀氫氯酸的熱容量為 \(546\ \text{J}\ \text{mo}{{\text{l}}^{-1}}\),而聚苯乙烯杯子的熱容量可略去不計。碳酸鎂的相對摩爾質量為 \(84.3\);答案保留至整數部分。
題解:
首先,計算反應過程中放出的熱:
\[Q=546\ \text{J}\ {{\text{K}}^{-1}}\times 6.2\ \text{K}=3\ 385\ \text{J }=3.38\ \text{kJ}\]然後,計算參與反應的碳酸鎂的摩爾數:
\[n=\frac{3.20\ \text{g}}{84.3\ \text{g}\ \text{mo}{{\text{l}}^{-1}}}=0.0380\ \text{mol}=3.80\times {{10}^{-2}}\ \text{mol}\]最後,計算反應的焓變(注意,放熱反應的焓變為負。):
\[\Delta {{H}_{\text{r}}}=-\frac{3.38\ \text{kJ}}{3.80\times {{10}^{-2}}\ \text{mol}}=-89\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}}\]由數據手冊可知,水的標準生成焓變為 \(-286\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}}\);二氧化碳的標準生成焓變為 \(-394\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}}\)。
題解:
\[\begin{align} \Delta {{H}_{\text{f}}}^{\rlap{-} o}\left[ \text{MgC}{{\text{O}}_{\text{3}}}\left( \text{s} \right) \right]\ &= \Delta {{H}_{\text{1}}}^{\rlap{-} o}\ \text{+}\ \Delta {{H}_{\text{f}}}^{\rlap{-} o}\left[ {{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right) \right]\ \text{+}\ \Delta {{H}_{\text{f}}}^{\rlap{-} o}\left[ \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) \right]-\Delta {{H}_{\text{2}}}^{\rlap{-} o} \\ &= \left[ \left( -465 \right)+\left( -286 \right)+\left( -394 \right)-\left( -89 \right) \right]\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}} \\ &= 1\ 056\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}} \\ \end{align}\]